Сера | Химия свойства элементов
Общие сведения и методы получения
Сера (S) — неметалл, представляющий собой хрупкие кристаллы желтого цвета.
Известна с древнейших времен (за 2000 лет до н.э.). Элементарную природу серы установил французский химик Лавуазье. В 1822 г, Ми-черлих обнаружил аллотропию серы. Название элемента связано с его цветом — от латинского «sulfur» светло-желтый. Русское название «сера» происходит от санскритского «сира», что также означает светло-желтый; имеется и другое древнерусское название серы «жупель» — сера горючая.
Общее содержание серы в земной коре составляет —0,1 % (по массе).
Сера встречается в природе как в свободном виде (самородная), так и в соединениях.
Известно более 200 минералов, содержащих серу. Наиболее распространены соединения серы с различными металлами — сульфиды: PbS — свинцовый блеск; ZnS — цинковая обманка; Cu2S —медный блеск; FeS2 — пирит; HgS — киноварь и др. Широко распространены в природе также сульфаты: Na2SO|- 10Н2О — глауберов»! соль; BaS04— тяжелый шпат; CaS04-2H20 — гипс и др. В виде сульфатов натрия, калия, магния и других элементов сера содержится в водах мирового океана (0,08—0,09 %), в углях, нефти, сланцах, природных газах.
Элементарную серу получают из самородных руд, используя ее способность легко плавиться. Полученную серу очищают перегонкой в рафинировочных печах, где она нагревается до кипения и конденсируется на стенках камеры в виде светло-желтого порошка или при температуре свыше 120 °С в виде жидкости, которую выпускают из камеры в формы, где она застывает в виде лалочек.
Серу получают также из сероводорода H2S и восстановлением диоксида серы S02.
Важными источниками получения серы являются пирит FeS2 и полиметаллические руды, содержащие сернистые соединения меди, цинка и других цветных металлов. Некоторое количество серы (газовая сера) получают из газов, образующихся при коксовании и газификации угля.
Физические свойства
Атомные характеристики. Атомный номер 16, атомная масса 32,064 а. е. м., атомный объем 15,38*10-6 м3/моль, атомный радиус 0,104 нм, ионные радиусы s2- 0,174 нм, s+ 0,037 нм, s6+ 0,034 нм. Конфигурация внешних электронных оболочек 3s23p4. Значения потенциалов ионизации / (эВ): 10,357; 23,4; 34,8. Сродство к электрону 2,07—2,33 эВ. Электроотрицательность 2,6.
Существует ряд кристаллических и аморфных модификаций серы. До 95,6 °С устойчива ромбическая, или a-S, с параметрами а= 1,04646 нм, 6=1,28660 нм, с = 2,44860 нм; в интервале 95,6—119,3°С моноклинная, или B -S, с параметрами решетки а=0,090 нм, 6=1,096 нм, с= 1,102 нм; 6 = 86 16′. Энергия кристаллической решетки серы 223,0 мкДж/ /кмоль. Выше 119,3°С Й -S переходит в жидкую X-S. При быстром нагреве ромбическая a-S непосредственно превращается в подвижную жидкость соломенного цвета X-S.
В жидкой сере наблюдается равновесие A ,-S =<=tB -s +n -s и при 160 °С в ней содержится 89,2 % ^-S; 4,1 % p-S; 6,7 % я -S.
Аморфная темно-красная пластическая p-S образуется при резком охлаждении жидкой серы; она нерастворима в сероуглероде и быстро переходит в ромбическую a-S.
Химические свойства
В соединениях сера проявляет степени окисления —2, +2, +3, +4, +5, +6.
Элементарная сера химически активна и взаимодействует при нагревании со многими металлами и неметаллами (за исключением золота, платины, азота, иода и инертных газов), с органическими и неорганическими соединениями. При комнатной температуре во влажном воздухе сера слабо окисляется, при 280 °С она горит в кислороде, а при 360 °С — на воздухе. Смесь паров серы и кислорода взрывается.
При обычных условиях сера с кислородом не взаимодействует. При цагреваиии на воздухе или в кислороде сера образует оксиды: S02 — оксид серы (IV), или сернистый газ, представляющий собой бесцветный газ с резким удушливым запахом, легко конденсирующийся в бесцветную жидкость, кипящую при —10 °С, хорошо растворяющуюся в воде с образованием сернистой кислоты H2S03; S03 — оксид серы (VI), серный ангидрид, представляющий собой бесцветную легкоподвижную жидкость, кипящую при 44,7 «С и кристаллизующуюся при 16,9 °С; при хранении в присутствии следов влаги превращается в длинные шелковистые кристаллы, хорошо растворяется в воде, образуя серную кислоту H2S04. Известны малоустойчивые оксиды серы: S20, SO, S203, S04, S07, S3O10.
Существует ряд кислородсодержащих кислот: H2S03— сернистая кислота — непрочное соединение, существует только в водных растворах, окисляется кислородом воздуха, превращаясь в серную кислоту H2S04, хороший восстановитель, двухосновная кислота, образует два ряда солей: сульфиты и гидросульфиты!
H2S04 — серная кислота — бесцветная маслянистая жидкость без запаха, нелетучая, кристаллизующаяся при 10,3 °С, тяжелая, активно поглощает пары воды, сильный окислитель, двухосновная кислота, образует два ряда солей: сульфаты и гидросульфаты, из которых практически нерастворимы только BaS04, PbS04 и SrS04.
H2S207 — пиросерная, или двусерная кислота. Растворением серного ангидрида S03 в серной кислоте получают олеум, состоящий главным образом из пиросерной кислоты. При охлаждении олеума кислота выделяется в виде бесцветных кристаллов. Пиросерная кислота образует соли — дисульфаты или пиросульфаты, которые при нагревании выше температуры плавления разлагаются, превращаясь в сульфаты.
H2S02 — сульфоксиловая кислота; в свободном состоянии не выделена.
H2S208 —пероксодвусерная, или надсерная, кислота, обладает сильными окислительными свойствами, образует соли персульфаты.
H2S202 — тиосернистая кислота, образуется как промежуточный продукт при различных реакциях.
H2S203 — тиосерная кислота — неустойчива, уже при комнатной температуре распадается, образует соли — тиосульфаты, которые значительно устойчивее кислоты.
H2S204 — дитионистая кислота, существует только в виде солей.
Существует группа политионовых кислот, отвечающих общей форму, ле H2S*06, где х принимает значения от 2 до 6. К группе таких кислот принадлежат H2S4O0 (тетратионовая кислота) и H2S2Oe (дитионовая кислота). Политионовые кислоты неустойчивы и известны лишь в водных растворах. Соли их — полнтионаты — более устойчивы, некоторые из них получены в виде кристаллов.
При обычных условиях сера с водородом ие соединяется, при нагревании образует соединения, отвечающие общей формуле PbS* — суль-фаны; H2S — сероводород; H2S2 — двухсернистый водород; H2S3 — трех-сернистый водород и т. д. Водные растворы сульфанов обладают свойствами слабых двухосновных кислот. Сероводород H2S —бесцветный газ с характерным запахом, ядовитый, немного тяжелее воздуха, горючий, легко воспламеняется, сильный восстановитель, хорошо растворяется в воде, образуя сероводородную кислоту, соли которой — сульфиды.
Остальные сульфаны — малоустойчивые желтоватые маслянистые жидкости; растворимы в воде с образованием соответствующих кислот, соли которых — полисульфиды.
Сера взаимодействует почти со всеми металлами (кроме золота, иридия, платины), образуя сульфиды. Прн комнатной температуре сера соединяется со щелочными н щелочноземельными металлами, а также с Си, Ag, Hg; при иагреваиин — с Pb, Sn, Ni, Со, Zn, Mn, Cr, Al; в присут ствии влаги — с Fe; тугоплавкие металлы н некоторые металлы платиновой группы взаимодействуют с серой прн высокой температуре в мелкораздробленном состоянии; некоторые — с парами серы под дав лением.
Различают основные сульфиды (Na2S, MgS), амфотерные (A1 2 S3, Cr 2 S3) и кислотные (MoS, WS3). Сульфиды могут соединяться друг с другом, образуя тиосоли (например. Na2WS4 — тиовольфрамат натрия).
Соединения серы с азотом получены косвенным путем. Известны N4S4 —азотистая сера — золотисто-желтые кристаллы с температурой плавления 178 °С; при ударе и нагревании выше температуры плавления разлагаются на элементы, в воде не растворяются; N2 S4 — четырехсер-иистый азот — темно-красные кристаллы с температурой плавления 23 °С, постепенно самопроизвольно разлагающиеся; при нагревании вспыхивают, в воде не растворяются; N2Ss — сернистый азот.
При 800—900 °С сера взаимодействует с углеродом, образуя сероуглерод CS2 — бесцветную жидкость, которая кипит при 40 °С, плохо растворяется в воде; сероуглерод хорошо растворяет жиры, масла, смолы, склонен к полимеризации. При взаимодействии углерода, кислорода и серы при высокой температуре образуется серооксид COS. Известны неустойчивые низшие сульфиды углерода: CS — белый налет, который уже при —180 «С со взрывом превращается в коричневый продукт полимери. зации (OS)*; несколько более устойчива C3S2 —слезоточивая жидкость, затвердевающая при 5 °С и склонная к полимеризации.
При сплавлении фосфора с серой, взятых в соответствующих соотношениях, образуются тиоангидриды P4S3, P4S5, P4S7, P4Si0, которые гид-ролизуются во влажном воздухе с выделением фосфииа РН3.
Галогены, за исключением иода, непосредственно соединяются с се рой. Уже на холоду сера энергично взаимодействует со фтором, образуя ряд соединений: SF6 — бесцветный газ, термически и химически стойкий, не реагирующий с водой, соляной кислотой, едким натром, водородом и кислородом; SF4 — бесцветный газ, энергично взаимодействующий с во-дой, термически устойчивый до 600 °С, хороший фторирующий агент; S2Fi0 и др.
При полном отсутствии влаги уже при комнатной температуре сера взаимодействует с хлором н бромом, образуя соединения: S2C19 — оранжево-желтую маслянистую жидкость с температурой кипения 137 «С, хорошо растворяющую серу, дымящую во влажном воздухе; в воде подвергается гидролизу; SC12 — красную жидкость с удушливым за. пахом, гидролитически разлагающуюся водой; SC14 — белый порошок, устойчивый только в твердом состоянии при низкой температуре; S2Br2 — красную маслянистую жидкость, очень чувствительную к влаге воздуха; прн температуре выше 90 °С разлагается на элементы.
Соединения серы с иодом неустойчивы, легко разлагаются. Получены соединения S*I2, где х —от 2 до 6.
Кроме того, известны галогенопроизводные сульфанов, имеющие общую формулу Sx(^)2, где X — галогены. Многообразны оксигалогениды серы общей формулы SO(A»)2и S02(X)2.
С водой и разбавленными кислотами сера не взаимодействует. Концентрированная азотная кислота окисляет серу до серной кислоты. Соляная кислота не действует на серу, но в присутствии окислителей пе реводит серу в серную кислоту. Царская водка также окисляет серу до серной кислоты. Концентрированная серная кислота на холоду на серу не действует, с расплавленной серой реагирует с образованием сернисто го газа S02и воды.
Со щелочами сера взаимодействует с образованием сульфидов и сульфитов (реакция обратимая). При нагревании в растворе аммиака NH3 сера образует полисульфид и тиосульфат аммония.
Расплавленная сера реагирует с оксидами щелочных металлов с образованием сульфидов, сульфитов и сульфатов. С оксидами тяжелых металлов сера заметно взаимодействует при 150—200 °С с выделением сернистого газа.
В воде сера практически не растворяется, хорошо растворяется в безводном аммиаке, сероуглероде и ряде органических растворителей (феноле, бензоле, дихлорэтане и др.).
Области применения
Основной потребитель серы — химическая промышленность: около 50% добываемой серы идет на производство серной кислоты. Большое количество серы расходуется в резиновой и целлюлозно-бумажной промышленности, вискозном и спичечном производстве, в органическом синтезе (получение сернистых красителей, сероуглерода, искусственных волокон, фармацевтических препаратов, ускорителей вулканизации каучука). Серу применяют при получении различных цементов, замазок, асфальтов, дымного пороха, светящихся составов, бенгальских огней.
В сельском хозяйстве серу широко применяют в виде серного цвета, используя для уничтожения некоторых вредителей растений; серные удобрения повышают морозостойкость растений и злаков.
Добавки серы улучшают обрабатываемость автоматных сталей и антифрикционные свойства спеченных антифрикционных материалов.
В медицине используют как элементарную серу, так и ее соединения. Все сульфамидные препараты — это органические соединения серы.
Широко применяются соединения серы:
— FeS2 (пирит) — для получения серной кислоты; сульфиды щелочных и щелочноземельных металлов (Na2S, CaS и BaS) —в кожевенной промышленности; сульфиды цинка ZnS и кадмия CdS служат основой люминофоров; некоторые сульфиды обладают полупроводниковыми свойствами и применяются в электронной технике; многие природные сульфиды используются в металлургии для выплавки цветных и редких металлов;
— оксид серы (IV) S02 — для получения серной кислоты; для отбеливания соломы, шерсти, шелка; как дезинфицирующее средство; для лечения домашних животных;
— сульфиты калия K2S03 и натрия Na2S0.3 для отбеливания некоторых материалов в текстильной промышленности при крашении тканей, в фотографии;
— гидросульфит кальция Ca(HS03)2 — при переработке древесины в сульфитную целлюлозу, из которой затем получают бумагу;
— сульфат натрия Na2S04 — при производстве стекла; глауберову соль Na2SO4-10H2O в медицине; гипс CaS04-2H20 для изготовления отливочных форм и слепков с различных предметов, в строительстве, в хирургии; медный купорос CaS04-5H20 — в сельском хозяйстве, для приготовления минеральных красок, для электролитического покрытия металлов медью; алюмокалиевые квасцы KA1(S04)2— 12Н20 — для дубления кожи, в красильном деле;
— олеум H2S207 — для очистки нефтепродуктов, для производства некоторых красителей и взрывчатых веществ;
— серная кислота H2S04 — для получения минеральных удобрений, некоторых кислот (НС1, Н3Р04 и др.), взрывчатых веществ, красок, при очистке керосина, нефтяных масел и продуктов коксохимического производства (бензола, толуола), при травлении черных металлов (снятия окалины), в свинцовых аккумуляторах;
— персульфаты — как средства для отбелки, в качестве окислителей в лабораторной практике и для некоторых технических целей;
— тиосульфат натрия Na2S203 — в фотографии как закрепитель, в текстильной промышленности для удаления остатков хлора после отбелки тканей, в медицине и ветеринарии;
— хлорид серы (I) S2C12 — для вулканизации каучука.
ibrain.kz
Физические и химические свойства серы
Электронная конфигурация 1s22s22p63s23p4. Символ – S . Относительная атомная масса – 32 а.е.м. Температура кипения – 444,67С, плавления – 112,85С. Неметалл.
Химические свойства серы
Сера взаимодействует с простыми веществами – неметаллами, проявляя при этом свойства восстановителя. Непосредственно сера взаимодействует только с фтором. Реакции взаимодействия с другими металлами происходят при нагревании:
S + F2 = SF6;
2S + Cl2 = S2Cl2;
S + Cl2 = SCl2;
5S + 2P = P2S5;
S + H2 = H2S;
2S + C = CS2;
S + O2 = SO2;
2S + Br2 = S2Br2.
В реакциях взаимодействия с простыми веществами – металлами сера проявляет свойства окислителя. Эти реакции протекают при нагревании и очень бурно:
2Na + S = Na2S;
Ca + S = CaS
2Al + 3S = Al2S3;
Fe + S = FeS.
Сера вступает в реакции взаимодействия со сложными веществами. Она способна растворяться в концентрированных кислотах и расплавах щелочей, причем в последнем случае сера диспропорционирует. Эти реакции происходят при кипении реакционной смеси:
3S + 6KOH = K2SO3 +2K2S + 3H2O;
S + 6HNO3 = H2SO4 + 6NO2↑ + 2H2O;
S + 2H2SO4 = 3SO2↑ + 2H2O.При взаимодействии серы с сульфидами металлов происходит образование полисульфидов:
Na2S + S = Na2S2.
Физические свойства серы
Сера – кристаллическое вещество желтого цвета. Существует в виде двух аллотропных модификаций – α-серы (ромбическая кристаллическая решетка) и β-серы (моноклинная кристаллическая решетка), а также аморфной формы – пластическая сера (рис. 1). В кристаллическом состоянии сера построена из неплоских циклических молекул S8. Сера плохо растворяется в этаноле, хорошо в сероуглероде и жидком аммиаке. Не реагирует с жидкой водой и йодом.
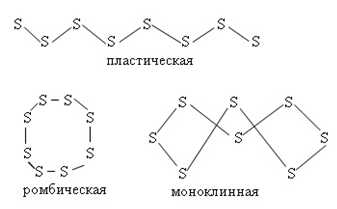
Рис. 1. Формы существования серы.
Получение и применение серы
В промышленных масштабах серу получают из природных месторождений самородной серы. Сера является сырьем для производства серной кислоты. Е1 используют в бумажной промышленности, в сельском хозяйстве, в производстве резины, красителей, пороха и т.д. Широкое применение сера нашла в медицине, например, сера входит в состав различных мазей и присыпок, применяемых при кожных заболеваниях и т.д.
Примеры решения задач
ru.solverbook.com
Физические и химические свойства серы
Сера – довольно распространенный в природе химический элемент (шестнадцатый по содержанию в земной коре и шестой – в природных водах). Встречаются как самородная сера (свободное состояние элемента) так и ее соединения.

Сера в природе
В числе важнейших природных минералов серы можно назвать железный колчедан, сфалерит, галенит, киноварь, антимонит. В Мировом океане содержится в основном в виде сульфатов кальция, магния и натрия, обуславливающих жесткость природных вод.
Как получают серу?
Добыча серных руд производится разными методами. Основным способом получения серы является ее выплавка непосредственно в местах залегания.
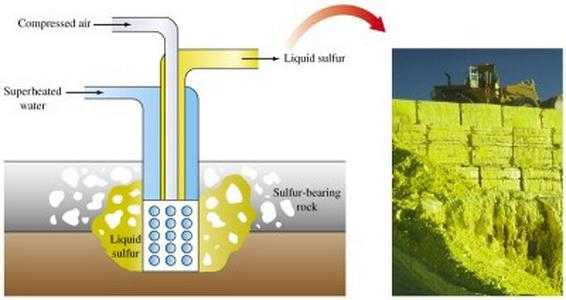
Открытый способ добычи предусматривает использование экскаваторов, снимающих породные пласты, которые покрывают серную руду. После дробления пластов руды взрывами их направляют на сероплавильный завод.
В промышленности серу получают как побочный продукт процессов в печах для плавки, при нефтепереработке. В больших количествах она присутствует в природном газе (в виде сернистого ангидрида или сероводорода), при добыче которого откладывается на стенках применяемого оборудования. Уловленную из газа мелкодисперсную серу используют в химической промышленности в качестве сырья для производства различной продукции.
Данное вещество можно получать и из природного сернистого газа. Для этого используется метод Клауса. Он заключается в применении «серных ям», в которых происходит дегазация серы. Результатом является модифицированная сера, широко использующаяся в производстве асфальта.
Основные аллотропические модификации серы
Сере присуща аллотропия. Известно большое количество аллотропических модификаций. Наиболее известными являются ромбическая (кристаллическая), моноклинная (игольчатая) и пластическая сера. Первые две модификации являются устойчивыми, третья при затвердевании превращается в ромбическую.

Физические свойства, характеризующие серу
Молекулы ромбической (α-S) и моноклинной (β-S) модификаций содержат по 8 атомов серы, которые соединены в замкнутый цикл одинарными ковалентными связями.

В обычных условиях сера имеет ромбическую модификацию. Представляет собой желтое твердое кристаллическое вещество с плотностью 2,07 г/см3. Плавится при 113 °C. Плотность моноклинной серы составляет 1,96 г/см3, температура ее плавления равна 119,3 °C.
При плавлении сера увеличивается в объеме и становится желтой жидкостью, которая буреет при температуре 160 °C и превращается в вязкую темно-коричневую массу при достижении около 190 °C. При температурах, превышающих это значение, вязкость серы уменьшается. При около 300 °C она снова переходит в жидкое текучее состояние. Это объясняется тем, что в процессе нагревания сера полимеризуется, с повышением температуры увеличивая длину цепочки. А при достижении температурного значения свыше 190 °C наблюдается разрушение полимерных звеньев.

При охлаждении расплава серы естественным путем в цилиндрических тиглях образуется так называемая комовая сера — ромбические кристаллы крупных размеров, имеющие искаженную форму в виде октаэдров с частично «срезанными» гранями или углами.
Если расплавленное вещество подвергнуть резкому охлаждению (к примеру, при помощи холодной воды), то можно получить пластическую серу, представляющую собой упругую каучукоподобную массу коричневатого или темно-красного цвета с плотностью 2,046 г/см3. Данная модификация, в отличие от ромбической и моноклинной, является неустойчивой. Постепенно (в течение нескольких часов) она меняет окраску на желтую, становится хрупкой и превращается в ромбическую.
При замораживании паров серы (сильно нагретых) жидким азотом образуется ее пурпурная модификация, которая является устойчивой при температурах ниже минус 80 °C.
В водной среде сера практически не растворяется. Однако характеризуется хорошей растворимостью в органических растворителях. Плохо проводит электричество и тепло.
Температура кипения серы равна 444,6 °C. Процесс кипения сопровождается выделением оранжево-желтых паров, состоящих преимущественно из молекул S8, которые при последующем нагревании диссоциируют, в результате чего образуются равновесные формы S6, S4 и S2. Далее при нагревании происходит распад крупных молекул, и при температуре выше 900 градусов пары состоят практически только из молекул S2, диссоциирующих на атомы при 1500 °С.
Какими химическими свойствами обладает сера?
Сера является типичным неметаллом. Химически активна. Окислительно—восстановительные свойства серы проявляются по отношению к множеству элементов. При нагревании легко соединяется практически со всеми элементами, что объясняет ее обязательное присутствие в металлических рудах. Исключение составляют Pt, Au, I2, N2 и инертные газы. Степени окисления, которые проявляет сера в соединениях, -2, +4, +6.
Свойства серы и кислорода обуславливают горение ее на воздухе. Результатом такого взаимодействия является образование сернистого (SO2) и серного (SO3) ангидридов, использующихся для получения сернистой и серной кислот.
При комнатной температуре восстановительные свойства серы проявляются только в отношении фтора, в реакции с которым образуется гексафторид серы:
При нагревании (в виде расплава) взаимодействует с хлором, фосфором, кремнием, углеродом. В результате реакций с водородом кроме сернистого водорода образует сульфаны, объединенные общей формулой H2SХ.
Окислительные свойства серы наблюдаются при взаимодействии с металлами. В некоторых случаях можно наблюдать довольно бурные реакции. В результате взаимодействия с металлами образуются сульфиды (сернистые соединения) и полисульфиды (многосернистые металлы).
При длительном нагревании вступает в реакции с концентрированными кислотами-окислителями, окисляясь при этом.
Далее рассмотрим основные свойства соединений серы.
Диоксид серы
Оксид серы (IV), называемый также диоксидом серы и ангидридом сернистым, представляет собой газ (бесцветный) с резким удушающим запахом. Имеет свойство сжижаться под давлением при комнатной температуре. SO2 является кислотным оксидом. Характеризуется хорошей растворимостью в воде. При этом образуется слабая, неустойчивая сернистая кислота, существующая только в водном растворе. В результате взаимодействия сернистого ангидрида со щелочами образуются сульфиты.
Отличается довольно высокой химической активностью. Наиболее ярко выраженными являются восстановительные химические свойства оксида серы (IV). Такие реакции сопровождаются повышением степени окисления серы.
Окислительные химические свойства оксида серы проявляются в присутствии сильных восстановителей (например, оксида углерода).
Триоксид серы
Триоксид серы (ангидрид серный) — высший оксид серы (VI). В обычных условиях представляет собой бесцветную легколетучую жидкость, характеризующуюся удушающим запахом. Имеет свойство застывать при температурных значениях ниже 16,9 градуса. При этом образуется смесь разных кристаллических модификаций твердого триоксида серы. Высокие гигроскопические свойства оксида серы обуславливают его «дымление» в условиях влажного воздуха. В результате образуются капельки серной кислоты.
Сероводород
Сероводород является бинарным химическим соединением водорода и серы. H2S — это ядовитый бесцветный газ, характерными особенностями которого являются сладковатый вкус и запах протухших яиц. Плавится при температуре минус 86 °С, кипит при минус 60 °С. Неустойчив термически. При температурных значениях выше 400 °С происходит разложение сернистого водорода на S и H2. Характеризуется хорошей растворимостью в этаноле. В воде растворяется плохо. В результате растворения в воде образуется слабая сероводородная кислота. Сероводород является сильным восстановителем.

Огнеопасен. При его горении в воздухе можно наблюдать синее пламя. В больших концентрациях способен вступать в реакции со многими металлами.
Серная кислота
Серная кислота (H2SO4) может быть разной концентрации и чистоты. В безводном состоянии является бесцветной маслянистой жидкостью, не имеющей запаха.
Значение температуры, при котором вещество плавится, составляет 10 °С. Температура кипения равна 296 °С. В воде растворяется хорошо. При растворении серной кислоты образуются гидраты, при этом выделяется большое количество теплоты. Температура кипения всех водных растворов при давлении 760 мм рт. ст. превышает 100 °С. Повышение точки кипения происходит с увеличением концентрации кислоты.

Кислотные свойства вещества проявляются при взаимодействии с основными оксидами и основаниями. H2SO4 является двухосновной кислотой, за счет чего может образовывать как сульфаты (средние соли), так и гидросульфаты (кислые соли), большинство из которых растворимы в воде.
Наиболее ярко свойства серной кислоты проявляются в окислительно-восстановительных реакциях. Это объясняется тем, что в составе H2SO4 у серы высшая степень окисления (+6). В качестве примера проявления окислительных свойств серной кислоты можно привести реакцию с медью:
- Cu + 2H2SO4 = CuSO4 + 2H2O + SO2.
Сера: полезные свойства
Сера является микроэлементом, необходимым для живых организмов. Является составной частью аминокислот (метионина и цистеина), ферментов и витаминов. Данный элемент принимает участие в образовании третичной структуры белка. Количество химически связанной серы, содержащейся в белках, составляет по массе от 0,8 до 2,4%. Содержание элемента в организме человека составляет около 2 граммов на 1 кг веса (то есть примерно 0,2% составляет сера).
Полезные свойства микроэлемента трудно переоценить. Защищая протоплазму крови, сера является активным помощником организма в борьбе с вредными бактериями. От ее количества зависит свертываемость крови, то есть элемент помогает поддерживать ее достаточный уровень. Также сера играет не последнюю роль в поддержании нормальных значений концентрации желчи, вырабатываемой организмом.
Часто ее называют «минералом красоты», поскольку она просто необходима для сохранения здоровья кожи, ногтей и волос. Сере присуща способность предохранять организм от различных видов негативного воздействия окружающей среды. Это способствует замедлению процессов старения. Сера очищает организм от токсинов и защищает от радиации, что особенно актуально в настоящее время, учитывая современную экологическую обстановку.
Недостаточное количество микроэлемента в организме может привести к плохому выведению шлаков, снижению иммунитета и жизненного тонуса.
Сера – участница бактериального фотосинтеза. Она является составляющей бактериохлорофилла, а сернистый водород — источником водорода.
Сера: свойства и применение в промышленности
Наиболее широко сера используется для производства серной кислоты. Также свойства данного вещества позволяют применять его для вулканизации каучука, в качестве фунгицида в сельском хозяйстве и даже лекарственного препарата (коллоидная сера). Кроме того, серу используют для производства спичек и пиротехнических составов, она входит в состав серобитумных композиций для изготовления сероасфальта.
fb.ru
1.6. Химические свойства серы
При комнатной температуре сера вступает в реакции только с ртутью. С повышением температуры её активность значительно повышается. При нагревании сера непосредственно реагирует со многими простыми веществами, за исключением инертных газов, азота, селена, теллура, золота, платины, иридия и йода. Сульфиды азота и золота получены косвенным путем.
Взаимодействие с металлами
Сера проявляет окислительные свойства, в результате взаимодействия образуются сульфиды:
Cu + S = CuS.
Взаимодействие с водородом происходит при 150–200 °С:
H2 + S = H2S.
Взаимодействие с кислородом
Сера горит в кислороде при 280 °С, на воздухе при 360 °С, при этом образуется смесь оксидов:
S + O2 = SO2;
2S + 3O2 = 2SO3.
Взаимодействие с фосфором и углеродом
При нагревании без доступа воздуха сера реагирует с фосфором, углеродом, проявляя окислительные свойства:
2P + 3S = P
2S + C = CS2.
Взаимодействие с фтором
В присутствии сильных окислителей проявляет восстановительные свойства:
S + 3F2 = SF6.
Взаимодействие со сложными веществами
При взаимодействии со сложными веществами сера ведет себя как восстановитель:
S + 2HNO3 = 2NO + H2SO4.
Реакция диспропорционирования
Сера способна к реакциям диспропорционирования, при взаимодействии со щелочью образуются сульфиды и сульфиты:
3S + 6KOH = K2S+4 O3 + 2K2S-2 + 3H2O.
1.7. Получение серы
- Из самородных руд
При нагревании пирита без доступа воздуха
FeS2 = FeS + S.
Окислением сероводорода при недостатке кислорода
2H2S + O2 = 2S + 2H2O.
Из отходящих газов металлургических и коксовых печей, при нагревании в присутствии катализатора
H2S + SO2 = 2H2O + 3S.
1.8. Сероводород
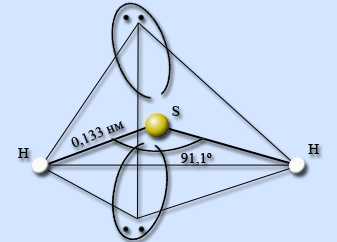
Водородное соединение серы – сероводород H2S. Сероводород – ковалентное соединение. Строение молекулы аналогично строению молекулы воды, атом серы находится в состоянии sp3-гибридизации, однако в отличие от воды молекулы сероводорода не образуют между собой водородных связей. Атом серы менее электроотрицательный, чем атом кислорода, имеет больший размер и, как следствие, меньшую плотность заряда. Валентный угол HSH составляет 91,1°, длина связи H – S равна 0,133 нм.
Физические свойства
При обычных условиях сероводород – бесцветный газ, с сильным характерным запахом тухлых яиц. Тпл = -86 °С,Ткип = -60 °С, плохо растворим в воде, при 20 °С в 100 г воды растворяется 2,58 мл H2S. Очень ядовит, при вдыхании вызывает паралич, что может привести к смертельному исходу. В природе выделяется в составе вулканических газов, образуется при гниении растительных и животных организмов. Хорошо растворим в воде, при растворении образует слабую сероводородную кислоту.
Химические свойства
В водном растворе сероводород обладает свойствами слабой двухосновной кислоты:
H2S = HS— + H+;
HS— = S2- + H+.
Сероводород горит в воздухе голубым пламенем. При ограниченном доступе воздуха образуется свободная сера:
2H2S + O2 = 2H2O + 2S.
При избыточном доступе воздуха горение сероводорода приводит к образованию оксида серы (IV):
2H2S + 3O2 = 2H2O + 2SО2.
Сероводород обладает восстановительными свойствами. В зависимости от условий сероводород может окисляться в водном растворе до серы, сернистого газа и серной кислоты.
Например, он обесцвечивает бромную воду:
H2S + Br2 = 2HBr + S.
H2S + 4Cl2 + 4H2O = H2SO4 + 8HCl.
Струю сероводорода можно поджечь, используя диоксид свинца, так как реакция сопровождается большим выделением тепла:
3PbO2 + 4H2S = 3PbS + SO2 + 4H2O.
Взаимодействие сероводорода с сернистым газом используется для получения серы из отходящих газов металлургического и сернокислого производства:
SO2 + 2H2S = 3S + 2H2O.
С этим процессом связано образование самородной серы при вулканических процессах.
При одновременном пропускании сернистого газа и сероводорода через раствор щелочи образуется тиосульфат:
4SO2 + 2H 2S + 6NaOH = 3Na2S2O3 + 5H2O.
studfiles.net
Сера
Сера
|
|||||||
Сера – одно из немногих веществ, которыми уже несколько тысяч лет назад оперировали первые «химики». Она стала служить человечеству задолго до того, как заняла в таблице Менделеева клетку под №16.
Об одном из самых древних (хотя и гипотетических!) применений серы рассказывают многие старинные книги. Как источник тепла при термообработке грешников серу живописуют и Новый и Ветхий заветы. И если книги такого рода не дают достаточных оснований для археологических раскопок в поисках остатков райских кущ или геенны огненной, то их свидетельство о том, что древние были знакомы с серой и некоторыми ее свойствами, можно принять на веру.
Одна из причин этой известности – распространенность самородной серы в странах древнейших цивилизаций. Месторождения этого желтого горючего вещества разрабатывались греками и римлянами, особенно в Сицилии, которая вплоть до конца прошлого века славилась в основном серой.
С древнейших времен серу использовали для религиозно-мистических целей, ее зажигали при различных церемониях и ритуалах. Но так же давно элемент №16 приобрел и вполне мирские назначения: серой чернили оружие, ее употребляли при изготовлении косметических и лекарственных мазей, ее жгли для отбелки тканей и для борьбы с насекомыми. Добыча серы значительно увеличилась после того, как был изобретен черный порох. Ведь сера (вместе с углем и селитрой) – непременный его компонент.
И сейчас пороховое производство потребляет часть добываемой серы, правда весьма незначительную. В наше время сера – один из важнейших видов сырья для многих химических производств. И в этом причина непрерывного роста мирового производства серы.
Происхождение серы
Большие скопления самородной серы встречаются не так уж часто. Чаще она присутствует в некоторых рудах. Руда самородной серы – это порода с вкраплениями серы.
Когда образовались эти вкрапления – одновременно с сопутствующими породами или позже? От ответа на этот вопрос зависит направление поисковых и разведочных работ. Но, несмотря на тысячелетия общения с серой, человечество до сих пор не имеет однозначного ответа. Существует несколько теорий, авторы которых придерживаются противоположных взглядов.
Теория сингенеза (т.е. одновременного образования серы и вмещающих пород) предполагает, что образование самородной серы происходило в мелководных бассейнах. Особые бактерии восстанавливали сульфаты, растворенные в воде, до сероводорода, который поднимался вверх, попадал в окислительную зону и здесь химическим путем или при участии других бактерий окислялся до элементарной серы. Сера осаждалась на дно, и впоследствии содержащий серу ид образовал руду.
Теория эпигенеза (вкрапления серы образовались позднее, чем основные породы) имеет несколько вариантов. Самый распространенный из них предполагает, что подземные воды, проникая сквозь толщи пород, обогащаются сульфатами. Если такие воды соприкасаются с месторождениями нефти или природного газа, то ионы сульфатов восстанавливаются углеводородами до сероводорода. Сероводород поднимается к поверхности и, окисляясь, выделяет чистую серу в пустотах и трещинах пород.
В последние десятилетия находит все новые подтверждения одна из разновидностей теории эпигенеза – теория метасоматоза (в переводе с греческого «метасоматоз» означает «замещение». Согласно ей в недрах постоянно происходит превращение гипса CaSO4 · 2H2O и ангидрита CaSO4 в серу и кальцит СаCO3. Эта теория создана в 1935 г. советскими учеными Л.М. Миропольским и Б.П. Кротовым. В ее пользу говорит, в частности, такой факт.
В 1961 г. в Ираке было открыто месторождение Мишрак. Сера здесь заключена в карбонатных породах, которые образуют свод, поддерживаемый уходящими вглубь опорами (в геологии их называют крыльями). Крылья эти состоят в основном из ангидрита и гипса. Такая же картина наблюдалась на отечественном месторождении Шор-Су.
Геологическое своеобразие этих месторождений можно объяснить только с позиций теории метасоматоза: первичные гипсы и ангидриты превратились во вторичные карбонатные руды с вкраплениями самородной серы. Важно не только соседство минералов – среднее содержание серы в руде этих месторождений равно содержанию химически связанной серы в ангидрите. А исследования изотопного состава серы и углерода в руде этих месторождений дали сторонникам теории метасоматоза дополнительные аргументы.
Но есть одно «но»: химизм процесса превращения гипса в серу и кальцит пока не ясен, и потому нет оснований считать теорию метасоматоза единственно правильной. На Земле и сейчас существуют озера (в частности, Серное озеро близ Серноводска), где происходит сингенетическое отложение серы и сероносный ил не содержит ни гипса, ни ангидрита.
Все это означает, что разнообразие теорий и гипотез о происхождении самородной серы – результат не только и не столько неполноты наших знаний, сколько сложности явлений, происходящих в недрах. Еще из элементарной школьной математики все мы знаем, что к одному результату могут привести разные пути. Этот закон распространяется и на геохимию.
Добыча серы
Серные руды добывают разными способами – в зависимости от условий залегания. Но в любом случае приходится уделять много внимания технике безопасности. Залежам серы почти всегда сопутствуют скопления ядовитых газов – соединений серы. К тому же нельзя забывать о возможности ее самовозгорания.
Добыча руды открытым способом происходит так. Шагающие экскаваторы снимают пласты пород, под которыми залегает руда. Взрывами рудный пласт дробят, после чего глыбы руды отправляют на обогатительную фабрику, а оттуда – на сероплавильный завод, где из концентрата извлекают серу. Методы извлечения различны. О некоторых из них будет рассказано ниже. А здесь уместно кратко описать скважинный метод добычи серы из-под земли, позволивший Соединенным Штатам Америки и Мексике стать крупнейшими поставщиками серы.
В конце прошлого века на юге Соединенных Штатов были открыты богатейшие месторождения серной руды. Но подступиться к пластам было непросто: в шахты (а именно шахтным способом предполагалось разрабатывать месторождение) просачивался сероводород и преграждал доступ к сере. Кроме того, пробиться к сероносным пластам мешали песчаные плавуны. Выход нашел химик Герман Фраш, предложивший плавить серу под землей и через скважины, подобные нефтяным, выкачивать ее на поверхность. Сравнительно невысокая (меньше 120°C) температура плавления серы подтверждала реальность идеи Фраша. В 1890 г. начались испытания, приведшие к успеху.
В принципе установка Фраша очень несложна: труба в трубе. В пространство между трубами подается перегретая вода и по нему идет в пласт. А по внутренней, обогреваемой со всех сторон, трубе поднимается расплавленная сера. Современный вариант установки Фраша дополнен третьей – самой узкой трубой. Через нее в скважину подается сжатый воздух, который помогает поднять расплавленную Серу на поверхность. Одно из основных достоинств метода Фраша – в том, что он позволяет уже на первой стадии добычи получить сравнительно чистую серу. При разработке богатых руд этот метод весьма эффективен.
Раньше считалось, что метод подземной выплавки серы применим только в специфических условиях «соляных куполов» тихоокеанского побережья США и Мексики. Однако опыты, проведенные в Польше и СССР, опровергли это мнение. В Польше этим методом уже добывают большое количество серы: в 1968 г. пущены первые серные скважины и в СССР.
А руду, полученную в карьерах и шахтах, приходится перерабатывать (часто с предварительным обогащением), используя для этого различные технологические приемы.
Известно несколько методов получения серы из серных руд: пароводяные, фильтрационные, термические, центрифугальные и экстракционные.
Термические методы извлечения серы – самые старые. Еще в XVIII в. в Неаполитанском королевстве выплавляли серу в кучах – «сольфатарах». До сих пор в Италии выплавляют серу в примитивных печах – «калькаронах». Тепло, необходимое для выплавления серы из руды, получают, сжигая часть добытой серы. Процесс этот малоэффективен, потери достигают 45%.
Италия стала родиной и пароводяных методов извлечения серы из руд. В 1859 г. Джузеппе Джилль получил патент на свой аппарат – предшественник нынешних автоклавов. Автоклавный метод (значительно усовершенствованный, конечно) используется и сейчас во многих странах.
В автоклавном процессе обогащенный концентрат серной руды, содержащий до 80% серы, в виде жидкой пульпы с реагентами подается насосами в автоклав. Туда же под давлением подается водяной пар. Пульпа нагревается до 130°C. Сера, содержащаяся в концентрате, плавится и отделяется от породы. После недолгого отстоя выплавленная сера сливается. Затем из автоклава выпускаются «хвосты» – взвесь пустой породы в воде. Хвосты содержат довольно много серы и вновь поступают на обогатительную фабрику.
В России автоклавный способ был впервые применен инженером К.Г. Паткановым в 1896 г.
Современные автоклавы – это огромные аппараты высотой с четырехэтажный дом. Такие автоклавы установлены, в частности, на сероплавильном заводе Роздольского горно-химического комбината в Прикарпатье.
На некоторых производствах, например на крупном серном комбинате в Тарнобжеге (Польша), пустую породу отделяют от расплавленной серы на специальных фильтрах. Метод разделения серы и пустой породы на центрифугах разработан в нашей стране. Словом, «руду золотую (точнее – золотистую) отделять от породы пустой» можно по-разному.
В последнее время все большее внимание уделяется скважинным геотехнологическим способам добычи серы. На Язовском месторождении в Прикарпатье серу – классический диэлектрик плавят под землей токами высокой частоты и выкачивают на поверхность через скважины, как в методе Фраша. Ученые Института горно-химического сырья предложили способ подземной газификации серы. По этому способу серу поджигают в пласте, а на поверхность выкачивают сернистый газ, который идет на производство серной кислоты и других полезных продуктов.
По-разному и удовлетворяют свои потребности в сере разные страны. Мексика и США используют в основном метод Фраша. Италия, занимающая по добыче серы третье место среди капиталистических государств, продолжает добывать и перерабатывать (разными методами) серные руды сицилийских месторождений и провинции Марке. У Японии есть значительные запасы серы вулканического происхождения. Франция и Канада, не имеющие самородной серы, развили крупное производство ее из газов. Нет собственных серных месторождений и в Англии и ФРГ. Свои потребности в серной кислоте они покрывают за счет переработки серусодержащего сырья (преимущественно пирита), а элементарную серу импортируют из других стран.
Советский Союз и социалистические страны полностью удовлетворяют свои потребности благодаря собственным источникам сырья. После открытия и освоения богатых Прикарпатских месторождений СССР и Польша значительно увеличили производство серы. Эта отрасль промышленности продолжает развиваться. В последние годы построены новые крупные предприятия на Украине, реконструированы старые комбинаты на Волге и в Туркмении, расширено производство серы из природного газа и отходящих газов.
Кристаллы и макромолекулы
В том, что сера – самостоятельный химический элемент, а не соединение, первым убедился великий французский химик Антуан Лоран Лавуазье в XVIII в.
С тех пор представления о сере как элементе изменились не очень сильно, но значительно углубились и дополнились.
Сейчас известно, что элемент №16 состоит из смеси четырех устойчивых изотопов с массовыми числами 32, 33, 34 и 36. Это типичный неметалл.
Лимонно-желтые кристаллы чистой серы полупрозрачны. Форма кристаллов не всегда одинакова. Чаще всего встречается ромбическая сера (наиболее устойчивая модификация) – кристаллы имеют вид октаэдров со срезанными углами. В эту модификацию при комнатной (или близкой к комнатной) температуре превращаются все прочие модификации. Известно, например, что при кристаллизации из расплава (температура плавления серы 119,5°C) сначала получаются игольчатые кристаллы (моноклинная форма). Но эта модификация неустойчива, и при температуре 95,6°C она переходит в ромбическую. Подобный процесс происходит и с другими модификациями серы.
Напомним известный опыт – получение пластической серы.
Если расплавленную серу вылить в холодную воду, образуется эластичная, во многом похожая на резину масса. Ее можно получить и в виде нитей. Но проходит несколько дней, и масса перекристаллизуется, становится жесткой и ломкой.
Молекулы кристаллов серы всегда состоят из восьми атомов (S8), а различие в свойствах модификаций серы объясняется полиморфизмом – неодинаковым строением кристаллов. Атомы в молекуле серы построены в замкнутый цикл, образующий своеобразный венец. При плавлении связи в цикле рвутся, и циклические молекулы превращаются в линейные.
Необычному поведению серы при плавлении даются различные толкования. Одно из них – такое. При температуре от 155 до 187°, по-видимому, происходит значительный рост молекулярного веса, это подтверждается многократным увеличением вязкости. При 187°C вязкость расплава достигает чуть ли не тысячи пуаз, получается почти твердое вещество. Дальнейший рост температуры приводит к уменьшению вязкости (молекулярный вес падает).
При 300°C сера вновь переходит в текучее состояние, а при 444,6°C закипает.
У паров серы с повышением температуры число атомов в молекуле постепенно уменьшается: S8 → S6 → S4 → (800°C) S2. При 1700°C пары серы одноатомны.
Коротко о соединениях серы
По распространенности элемент №16 занимает 15-е место. Содержание серы в земной коре составляет 0,05% по весу. Это немало.
К тому же сера химически активна и вступает в реакции с большинством элементов. Поэтому в природе сера встречается не только в свободном состоянии, но и в виде разнообразных неорганических соединений. Особенно распространены сульфаты (главным образом щелочных и щелочноземельных металлов) и сульфиды (железа, меди, цинка, свинца). Сера есть и в углях, сланцах, нефти, природных газах, в организмах животных и растений.
При взаимодействии серы с металлами, как правило, выделяется довольно много тепла. В реакциях с кислородом сера дает несколько окислов, из них самые важные SO2 и SO3 – ангидриды сернистой H2SO3 и серной Н2SO4 кислот. Соединение серы с водородом – сероводород H2S – очень ядовитый зловонный газ, всегда присутствующий в местах гниения органических остатков. Земная кора в местах, расположенных близ месторождений серы, часто содержит довольно значительные количества сероводорода. В водном растворе этот газ обладает кислотными свойствами. Хранить его растворы на воздухе нельзя, он окисляется с выделением серы:
2H2S + О2 → 2Н2О + 2S.
Сероводород – сильный восстановитель. Этим его свойством пользуются во многих химических производствах.
Для чего нужна сера
Среди вещей, окружающих нас, мало таких, для изготовления которых не нужны были бы сера и ее соединения. Бумага и резина, эбонит и спички, ткани и лекарства, косметика и пластмассы, взрывчатка и краска, удобрения и ядохимикаты – вот далеко не полный перечень вещей и веществ, для производства которых нужен элемент №16. Для того чтобы изготовить, например, автомобиль, нужно израсходовать около 14 кг серы. Можно без преувеличения сказать, что промышленный потенциал страны довольно точно определяется потреблением серы.
Значительную часть мировой добычи серы поглощает бумажная промышленность (соединения серы помогают выделить целлюлозу). Для того чтобы произвести 1 т целлюлозы, нужно затратить более 100 кг серы. Много элементарной серы потребляет и резиновая промышленность – для вулканизации каучуков.
В сельском хозяйстве сера применяется как в элементарном виде, так и в различных соединениях. Она входит в состав минеральных удобрений и препаратов для борьбы с вредителями. Наряду с фосфором, калием и другими элементами сера необходима растениям. Впрочем, большая часть вносимой в почву серы не усваивается ими, но помогает усваивать фосфор. Серу вводят в почву вместе с фосфоритной мукой. Имеющиеся в почве бактерии окисляют ее, образующиеся серная и сернистая кислоты реагируют с фосфоритами, и в результате получаются фосфорные соединения, хорошо усваиваемые растениями.
Однако основной потребитель серы – химическая промышленность. Примерно половина добываемой в мире серы идет на производство серной кислоты. Чтобы получить 1 т H2SО4, нужно сжечь около 300 кг серы. А роль серной кислоты в химической промышленности сравнима с ролью хлеба в нашем питании.
Значительное количество серы (и серной кислоты) расходуется при производстве взрывчатых веществ и спичек. Чистая, освобожденная от примесей сера нужна для производства красителей и светящихся составов.
Соединения серы находят применение в нефтехимической промышленности. В частности, они необходимы при производстве антидетонаторов, смазочных веществ для аппаратуры сверхвысоких давлений; в охлаждающих маслах, ускоряющих обработку металла, содержится иногда до 18% серы.
Перечисление примеров, подтверждающих первостепенную важность элемента №16, можно было бы продолжить, но «нельзя объять необъятное». Поэтому вскользь упомянем, что сера необходима и таким отраслям промышленности, как горнодобывающая, пищевая, текстильная, и – поставим точку.
Наш век считается веком «экзотических» материалов – трансурановых элементов, титана, полупроводников и так далее. Но внешне непритязательный, давно известный элемент №16 продолжает оставаться абсолютно необходимым. Подсчитано, что в производстве 88 из 150 важнейших химических продуктов используют либо саму серу, либо ее соединения.
Из древних и средневековых книг
«Сера применяется для очищения жилищ, так как многие держатся мнения, что запах и горение серы могут предохранить от всяких чародейств и прогнать всякую нечистую силу».
Плиний Старший, «Естественная история» I в. н.э.
«Если травы чахлы, бедны соками, а ветви и листва деревьев имеют окраску тусклую, грязную, темноватую вместо блестящего зеленого цвета, это признак, что подпочва изобилует минералами, в которых господствует сера».
«Если руда очень богата серой, ее зажигают на широком железном листе с множеством отверстий, через которые сера вытекает в горшки, наполненные доверху водой».
«Сера входит также в состав ужасного изобретения – порошка, который может метать далеко вперед куски железа, бронзы или камня – орудие войны нового тина».
Агрикола, «О царстве минералов», XVI в.
Как испытывали серу в XIV веке
«Если ты хочешь испытать серу, хороша она или нет, то возьми кусок серы в руку и поднеси к уху. Если сера трещит так, что ты слышишь ее треск, значит она хороша; если же сера молчит и не трещит, то она нехороша…»
Этот своеобразный метод определения качества материала на слух (применительно к сере) может быть использован и сейчас. Экспериментально подтвердилось, что «трещит» только сера, содержащая не больше одного процента примесей. Иногда дело не ограничивается только треском – кусок серы раскалывается на части.
Удушающий серный газ
Как известно, выдающийся естествоиспытатель древности Плиний Старший погиб в 79 г. н.э. при извержении вулкана. Его племянник в письме историку Тациту писал: «…Вдруг раздались раскаты грома, и от горного пламени покатились вниз черные серные пары. Все разбежались. Плиний поднялся и, опираясь на двух рабов, думал тоже уйти; но смертоносный пар окружил его со всех сторон, его колени подогнулись, он снова упал и задохся».
«Черные серные пары», погубившие Плиния, состояли, конечно, не только из парообразной серы. В состав вулканических газов входят и сероводород, и двуокись серы. Эти газы обладают не только резким запахом, но и большой токсичностью. Особенно опасен сероводород. В чистом виде он убивает человека почти мгновенно. Опасность велика даже при незначительном (порядка 0,01%) содержании сероводорода в воздухе. Сероводород тем более опасен, что он может накапливаться в организме. Он соединяется с железом, входящим в состав гемоглобина, что может привести к тяжелейшему кислородному голоданию и смерти. Сернистый газ (двуокись серы) менее токсичен, однако выпуск его в атмосферу приводил к тому, что вокруг металлургических заводов гибла вся растительность. Поэтому на всех предприятиях, производящих или использующих эти газы; вопросам техники безопасности уделяется особое внимание.
Сернистый газ и соломенная шляпка
Соединяясь с водой, сернистый газ образует слабую сернистую кислоту Н2SO3, существующую только в растворах. В присутствии влаги сернистый газ обесцвечивает многие красители. Это свойство используется для отбелки шерсти, шелка, соломы. Но такие соединения, как правило, не обладают большой стойкостью, и белые соломенные шляпки со временем приобретают первоначальную грязно-желтую окраску.
Не асбест, хотя и похож
Сернистый ангидрид SO3 в обычных условиях представляет собой бесцветную очень летучую жидкость, кипящую при 44,8°C. Твердеет он при –16,8°C и становится очень похожим на обыкновенный лед. Но есть и другая – полимерная модификация твердого серного ангидрида (формулу его в этом случае следовало бы писать (SO3)n). Внешне она очень похожа на асбест, ее волокнистую структуру подтверждают рентгенограммы. Строго определенной точки плавления эта модификация не имеет, что свидетельствует о ее неоднородности.
Гипс и алебастр
Гипс CaSO4 · 2Н2O – один из самых распространенных минералов. Но распространенные в медицинской практике «гипсовые шины» делаются не из природного гипса, а из алебастра. Алебастр отличается от гипса только количеством кристаллизационной воды в молекуле, его формула 2CaSO4 · Н2O. При «варке» алебастра (процесс идет при 160…170°C в течение 1,5…2 часов) гипс теряет три четверти кристаллизационной воды, и материал приобретает вяжущие свойства. Алебастр жадно захватывает воду, при этом происходит быстрая беспорядочная кристаллизация. Разрастись кристаллики не успевают, но сплетаются друг с другом; масса, образованная ими, в мельчайших подробностях воспроизводит форму, в которой происходит твердение. Химизм происходящего в это время процесса обратен происходящему при варке: алебастр превращается в гипс. Поэтому отливка – гипсовая, маска – гипсовая, повязка – тоже гипсовая, а делаются они из алебастра.
Глауберова соль
Соль Na2SO4 · 10H2O, открытая крупнейшим немецким химиком XVII в. Иоганном Рудольфом Глаубером и названная в его честь, до сих пор широко применяется в медицине, стеклоделии, кристаллографических исследованиях. Глаубер так описывал ее: «Эта соль, если она хорошо приготовлена, имеет вид льда; она образует длинные, совершенно прозрачные кристаллы, которые растапливаются на языке, как лед. У нее вкус обыкновенной соли, без всякой едкости. Брошенная на пылающие угли, она не растрескивается с шумом, как обыкновенная кухонная соль, и не воспламеняется со взрывом, как селитра. Она без запаха и выносит любую степень жара. Ее можно применять с выгодой в медицине как снаружи, так и внутрь. Она заживляет свежие раны, не раздражая их. Это превосходное внутреннее лекарство: будучи растворена в воде и дана больному, она очищает кишки».
Минерал глауберовой соли называется мирабилитом (от латинского «mirabilis» – удивительный). Название происходит от имени, которое дал Глаубер открытой им соли; он назвал ее чудесной. Крупнейшие в мире разработки этого вещества находятся в нашей стране, чрезвычайно богата глауберовой солью вода знаменитого залива Кара-Богаз-Гол. Дно залива буквально устлано ею.
Сульфиты, сульфаты, тиосульфаты…
Если вы фотолюбитель, вам необходим фиксаж, т.е. натриевая соль серноватистой (тиосерной) кислоты Н2S2O3. Тиосульфат натрия Na2S2O3 (он же гипосульфит) служил поглотителем хлора в первых противогазах.
Если вы порезались во время бритья, кровь можно остановить кристаллом алюмокалиевых квасцов KAl(SO4)2 · 12H2O.
Если вы хотите побелить потолки, покрыть медью какой-либо предмет или уничтожить вредителей в саду – вам не обойтись без темно-синих кристаллов медного купороса CuSO4 · 5Н2О.
Если врачи порекомендовали вам очистить желудок, воспользуйтесь горькой солью MgSО4. (Она же придает горький вкус морской воде.)
Бумага, на которой напечатана эта книга, сделана с помощью гидросульфита кальция Са(НSO3)2.
Широко используются также железный купорос FeSO4 · 7H2O, хромовые квасцы K2SO4 · Cr2(SO4)3 · 2Н2O и многие другие соли серной, сернистой и тиосерной кислот.
Киноварь
Если в лаборатории разлили ртуть (возникла опасность отравления ртутными парами!), ее первым делом собирают, а те места, из которых серебристые капли не извлекаются, засыпают порошкообразной серой. Ртуть и сера вступают в реакцию даже в твердом состоянии – при простом соприкосновении. Образуется кирпично-красная киноварь – сульфид ртути – химически крайне инертное и безвредное вещество.
Выделить ртуть из киновари несложно. Многие другие металлы, в частности железо, вытесняют ртуть из киновари.
Серобактерии
В природе постепенно происходит круговорот серы, подобный круговороту азота или углерода. Растения потребляют серу – ведь ее атомы входят в состав белка. Растения берут серу из растворимых сульфатов, а гнилостные бактерии превращают серу белков в сероводород (отсюда – отвратительный запах гниения).
Но есть так называемые серобактерии, которым вообще не нужна органическая пища. Они питаются сероводородом, и в их организмах в результате реакции между H2S, CO2 и О2 образуются углеводы и элементарная сера. Серобактерии нередко оказываются переполнены крупинками серы – почти всю их массу составляет сера с очень небольшой «добавкой» органических веществ.
Сера – фармацевтам
Все сульфамидные препараты – сульфидин, сульфазол, норсульфазол, сульгин, сульфодимезин, стрептоцид и другие подавляют активность многочисленных микробов. И все эти лекарства – органические соединения серы. Вот структурные формулы некоторых из них:
После появления антибиотиков роль сульфамидных препаратов несколько уменьшилась. Впрочем, и многие антибиотики можно рассматривать как органические производные серы. В частности, она обязательно входит в состав пенициллина.
Мелкодисперсная элементарная сера – основа мазей, применяемых при лечении грибковых заболеваний кожи.
Нитрид серы проводит ток
В 1975 г. журнал «Кэмикл энд инжениринг ньюс» сообщил о получении нового неорганического полимера, у которого многие свойства – как у металла. Полимерный нитрид серы – политиазил (SN)n легко прессуется и куется, его электропроводность близка к электропроводности ртути. При этом пленки из политиазила не одинаково проводят ток в продольном и поперечном направлении. Это объясняется тем, что пленка построена из упорядоченных, расположенных параллельно друг другу полимерных волокон.
Что можно построить из серы
В 70-х годах в некоторых странах мира производство серы превысило потребности в ней. Поэтому сере стали искать новые применения, прежде всего в таких материалоемких областях, как строительство. В результате этих поисков появились серный пенопласт – как теплоизоляционный материал, бетонные смеси, в которых серой частично или полностью заменен портландцемент, покрытия для автострад, содержащие элементарную серу.
himiya.okis.ru
Сера (S, Sulphur) — влияние на организм, польза и вред, описание
История серы
Сера и её соединения сопровождают историю человечества с незапамятных времён. Как правило, использовались не самые приятные запахи – горения серы, сероводорода и сернистого газа, наделяя вещество, которое могло испускать такие зловонья, поистине волшебными или даже божественными свойствами. Недаром одним из традиционных применений серы было изготовление священных курений и использование их во многих обрядах некоторых религий (calorizator). Параллельно серу вводили в состав горючих смесей, применяемых во время военных действий. Антуан Лавуазье, считающийся основателем современной науки химии, первым выяснил элементарную природу серы, которую стали получать из пиритов.
Общая характеристика серы
Сера является элементом XVI группы III периода периодической системы химических элементов Д.И. Менделеева, имеет атомный номер 16 и атомную массу 32,066. Принятое обозначение S (от латинского sulfur).

Физические и химические свойства
Сера является неметаллическим веществом, образующим соли и кислоты. Считается макроэлементом. При взаимодействии с воздухом происходит возгорание серы с образованием газа без цвета, но с резким запахом – сернистого ангидрида.
Продукты питания богатые серой
Богаты серой мясные и рыбные продукты – индейка, говядина, свинина, мясо кролика, курица, говяжья и индюшачья печень, морская рыба (камбала, сардина, окунь, зубатка), перепелиные и куриные яйца, сыр, крупы и бобовые, овощи (белокочанная и брюссельская капуста, лук, чеснок, салат, репа).

Суточная потребность в сере
Норма потребления серы в сутки составляет 0,5-1 г, обычного питания вполне хватает, чтобы получить суточную норму. Спортсменам перед соревнованиями, если нужно набрать массу, серы потребуется до 3 г в сутки, для этого можно увеличить количество белковой пищи или ввести в рацион минеральную воду с содержанием серы.
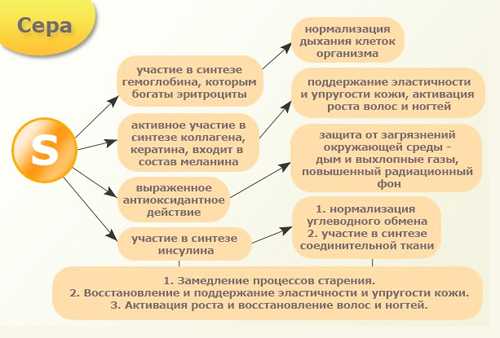
Полезные свойства серы и его влияние на организм
Сера – незаменимый макроэлемент, без неё невозможны многие важнейшие процессы в организме человека. Сера играет важную роль в процессе свёртываемости крови, защищает протоплазму от вредных бактерий, является важным элементом в синтезе коллагена, поэтому благотворно влияет на состояние кожи, волос и ногтей, замедляет процессы старения организма, оказывает противоаллергическое действие.
Взаимодействие с другими
Сера усваивается быстрее при нормальном количестве в организме железа и фтора, молибден, селен и свинец задерживают усвояемость серы.
Признаки нехватки серы
Признаками дефицита серы в организме считаются:
- Снижение иммунитета и жизненного тонуса;
- Хроническая усталость;
- Запоры;
- Хрупкость ногтей и тусклость волос;
- Воспаления на коже;
- Болезненность суставов.
Признаки избытка серы
Переизбыток серы в организме крайне редок, встречается лишь в регионах, где отмечается пониженное содержание серы.
Применение серы в жизни
Сера – основа для производства серной кислоты, сферы её применения – бумажная и резиновая промышленность, сельское хозяйство, производство пороха и спичек, медицина.

Автор: Виктория Н. (специально для Calorizator.ru)
Копирование данной статьи целиком или частично запрещено.
www.calorizator.ru
Сера S химический элемент
Сера — одно из немногих веществ, которыми уже несколько тысяч лет назад оперировали первые «химики». Она стала служить человечеству задолго до того, как заняла в таблице Менделеева клетку под № 16.
СераОб одном из самых древних (хотя и гипотетических!) применений серы рассказывают многие старинные книги. Как источник тепла при термообработке грешников серу живописуют и Новый и Ветхий заветы. И если книги такого рода не дают достаточных оснований для археологических раскопок в поисках остатков райских кущ или геенны огненной, то их свидетельство о том, что древние были знакомы с серой и некоторыми ее свойствами, можно принять на веру.
Самородная сера
Одна из причин этой известности — распространенность самородной серы в странах, древнейших цивилизаций. Месторождения этого желтого горючего вещества разрабатывались греками и римлянами, особенно в Сицилии, которая вплоть до конца прошлого века славилась в основном серой.
С древнейших времен серу использовали для религиозно-мистических целей, ее зажигали при различных церемониях и ритуалах. Но так же давно элемент № 16 приобрел и вполне мирские назначения: серой чернили оружие, ее употребляли при изготовлении косметических и лекарственных мазей, ее жгли для отбелки тканей и для борьбы с насекомыми. Добыча серы значительно увеличилась после того, как был изобретен черный порох. Ведь сера (вместе с углем и селитрой) — непременный его компонент.
И сейчас пороховое производство потребляет часть добываемой серы, правда весьма незначительную. В наше время сера — один из важнейших видов сырья для многих химических производств. И в этом причина непрерывного роста мирового производства серы.
Большие скопления самородной серы встречаются не так уж часто. Чаще она присутствует в некоторых рудах. Руда самородной серы — это порода с вкраплениями серы.
Когда образовались эти вкрапления — одновременно с сопутствующими породами или позже? От ответа на этот вопрос зависит направление поисковых и разведочных работ. Но, несмотря на тысячелетия общения с серой, человечество до сих пор не имеет однозначного ответа. Существует несколько теорий, авторы которых придерживаются противоположных взглядов.
Теория сингенеза (т. е. одновременного образования серы и вмещающих пород) предполагает, что образование самородной серы происходило в мелководных бассейнах. Особые бактерии восстанавливали сульфаты, растворенные в воде, до сероводорода, который поднимался вверх, попадал в окислительную зону и здесь химическим путем или при участии других бактерий окислялся до элементной серы. Сера осаждалась на дно, и впоследствии содержащий серу ил образовал руду.
Интересное о сере
ИЗ ДРЕВНИХ И СРЕДНЕВЕКОВЫХ КНИГ.
«Сера применяется для очищения жилищ, так как многие держатся мнения, что запах и горение серы могут предохранить от всяких чародейств и прогнать всякую нечистую силу».
Плиний Старший.
«Естественная история». I в. н.э.
«Если травы чахлы, бедны соками, а ветви и листва деревьев имеют окраску тусклую, грязную, темноватую вместо блестящего зеленого цвета, это признак, что подпочва изобилует минералами, в которых господствует сера».
«Если руда очень богата серой, ее зажигают на широком железном листе с множеством отверстий, через которые сера вытекает в горшки, наполненные доверху водой».
«Сера входит также в состав ужасного изобретения — порошка, который может метать далеко вперед куски железа, бронзы или камня — орудие войны нового типа».
Агрикола.
«О царстве минералов». XVI в.
КАК ИСПЫТЫВАЛИ СЕРУ в XIV ВЕКЕ. «Если ты хочешь испытать серу, хороша она или нет, то возьми кусок серы в руку и поднеси к уху. Если сера трещит так, что ты слышишь ее треск, значит она хороша; если же сера молчит и не трещит, то она нехороша…»
Этот своеобразный метод определения качества материала на слух (применительно к сере) может быть использован и сейчас. Экспериментально подтвердилось, что «трещит» только сера, содержащая не больше одного процента примесей. Иногда дело не ограничивается только треском — кусок серы раскалывается на части.
УДУШАЮЩИЙ СЕРНЫЙ ГАЗ. Как известно, выдающийся естествоиспытатель древности Плиний Старший погиб в 79 г. н.э. при извержение вулкана. Его племянник в письме историку Тациту писал: «… Вдруг раздались раскаты грома, и от горного пламени покатились вниз черные серные пары. Все разбежались. Плиний поднялся и, опираясь на двух рабов, думал тоже уйти; но смертоносный пар окружил его со всех сторон, его колени подогнулись, он снова упал и задохся».
«Черные серные пары», погубившие Плиния, состояли, конечно, не только из парообразной серы. В состав вулканических газов входят и сероводород, и двуокись серы. Эти газы обладают не только резким запахом, но и большой токсичностью. Особенно опасен сероводород. В чистом виде он убивает человека почти мгновенно. Опасность велика даже при незначительном (порядка 0,01%) содержании сероводорода в воздухе. Сероводород тем более опасен, что он может накапливаться в организме. Он соединяется с железом, входящим в состав гемоглобина, что может привести к тяжелейшему кислородному голоданию и смерти. Сернистый газ (двуокись серы) менее токсичен, однако выпуск его в атмосферу приводил к тому, что вокруг металлургических заводов гибла вся растительность. Поэтому на всех предприятиях, производящих или использующих эти газы, вопросам техники безопасности уделяется особое внимание.
СЕРНИСТЫЙ ГАЗ И СОЛОМЕННАЯ ШЛЯПКА. Соединяясь с водой, сернистый газ образует слабую сернистую кислоту H2SO3, существующую только в растворах. В присутствии влаги сернистый газ обесцвечивает многие красители. Это свойство используется для отбелки шерсти, шелка, соломы. Но такие соединения, как правило, не обладают большой стойкостью, и белые соломенные шляпки со временем приобретают первоначальную грязно-желтую окраску.
HE АСБЕСТ, ХОТЯ И ПОХОЖ. Сернистый ангидрид SO3 в обычных условиях представляет собой бесцветную очень летучую жидкость, кипящую при 44,8°С. Твердеет он при — 16,8°С и становится очень похожим на обыкновенный лед. Но есть и другая — полимерная модификация твердого серного ангидрида (формулу его в этом случае следовало бы писать (SO3)n. Внешне она очень похожа на асбест, ее волокнистую структуру подтверждают рентгенограммы. Строго определенной точки плавления эта модификация не имеет, что свидетельствует о ее неоднородности.
ГИПС и АЛЕБАСТР. Гипс CaSO4-2H2O — один из самых распространенных минералов. Но распространенные в медицинской практике «гипсовые шипы» делаются не из природного гипса, а из алебастра. Алебастр отличается от гипса только количеством кристаллизационной воды в молекуле, его формула 2CaSO4-H2O. При «варке» алебастра (процесс идет при 160-170°С в течение 1,5-2 часов) гипс теряет три четверти кристаллизационной воды, и материал приобретает вяжущие свойства. Алебастр жадно захватывает воду, при этом происходит быстрая беспорядочная кристаллизация. Разрастись кристаллики не успевают, но сплетаются друг с другом; масса, образованная ими, в мельчайших подробностях воспроизводит форму, в которой происходит твердение. Химизм происходящего в это время процесса обратен происходящему при варке: алебастр превращается в гипс. Поэтому отливка — гипсовая, маска — гипсовая, повязка — тоже гипсовая, а делаются они из алебастра.
ГЛАУБЕРОВА СОЛЬ. Соль Na2SO4*10H2O, открытая крупнейшим немецким химиком XVII в. Иоганном Рудольфом Глаубером и названная в его честь, до сих пор широко применяется в медицине, стеклоделии, кристаллографических исследованиях. Глаубер так описывал ее: «Эта соль, если она хорошо приготовлена, имеет вид льда; она образует длинные, совершенно прозрачные кристаллы, которые растапливаются на языке, как лед. У нее вкус обыкновенной соли, без всякой едкости. Брошенная на пылающие угли, она не растрескивается с шумом, как обыкновенная кухонная соль, и не воспламеняется со взрывом, как селитра. Она без запаха и выносит любую степень жара. Ее можно применять с выгодой в медицине как снаружи, так и внутрь. Она заживляет свежие раны, не раздражая их. Это превосходное внутреннее лекарство: будучи растворена в воде и дана больному, она очищает кишки».
Минерал глауберовой соли называется мирабилитом (от латинского «mimbilis» — удивительный). Название происходит от имени, которое дал Глаубер открытой им соли; он назвал ее чудесной. Крупнейшее в мире разработки этого вещества находятся в нашей стране, чрезвычайно богата глауберовой солью вода знаменитого залива (теперь озера) Кара-Богаз-Гол.
СУЛЬФИТЫ, СУЛЬФАТЫ, ТИОСУЛЬФАТЫ… Если вы фотолюбитель, вам необходим фиксаж, т. е. натриевая соль серноватистой (тиосерной) кислоты H2S2O3. Тиосульфат натрия Na2S2O3 (он же гипосульфит) служил поглотителем хлора в первых противогазах. Если вы порезались во время бритья, кровь можно остановить кристаллом алюмокалиевых квасцов KAl(SO4)2-12H2O. Если вы хотите побелить потолки, покрыть медью какой-либо предмет или уничтожить вредителей в саду — вам не обойтись без темносиних кристаллов медного купороса CuSO4*5H2O. Если врачи порекомендовали вам очистить желудок, воспользуйтесь горькой солью MgSO4. (Она же придает горький вкус морской воде.)
Широко используются также железный купорос FeSO4*7h3O, хромовые квасцы K2SO4Cr2(SO4)3*2H2O и многие другие соли серной, сернистой и тиосерной кислот.
КИНОВАРЬ. Если в лаборатории разлили ртуть (возникла опасность отравления ртутными парами!), ее первым делом собирают, а те места, из которых серебристые капли не извлекаются, засыпают порошкообразной серой. Ртуть и сера вступают в реакцию даже в твердом состоянии — при простом соприкосновении. Образуется кирпично-красная киноварь — сульфид ртути — химически крайне инертное и безвредное вещество. Выделить ртуть из киновари несложно. Многие другие металлы, в частности железо, вытесняют ртуть из киновари.
СЕРОБАКТЕРИИ. В природе постепенно происходит круговорот серы, подобный круговороту азота или углерода. Растения потребляют серу — ведь ее атомы входят в состав белка. Растения берут серу из растворимых сульфатов, а гнилостные бактерии превращают серу белков в сероводород (отсюда — отвратительный запах гниения). Но есть так называемые серобактерии, которым вообще не нужна органическая пища. Они питаются сероводородом, и в их организмах в результате реакции между H2S, CO2 и O2 образуются углеводы и элементная сера. Серобактерии нередко оказываются переполнены крупинками серы — почти всю их массу составляет сера с очень небольшой «добавкой» органических веществ.
СЕРА — ФАРМАЦЕВТАМ. Все сульфамидные препараты — сульфидин, сульфазол, норсульфазол, сульгин, сульфадимезин, стрептоцид и другие подавляют активность многочисленных микробов. И все эти лекарства — органические соединения серы. После появления антибиотиков роль сульфамидных препаратов несколько уменьшилась. Впрочем, и многие антибиотики можно рассматривать как органические производные серы. В частности, она обязательно входит в состав пенициллина.
Мелкодисперсная элементная сера — основа мазей, применяемых при лечении грибковых заболеваний кожи.
ЧТО МОЖНО ПОСТРОИТЬ ИЗ СЕРЫ. В 70-х годах в некоторых странах мира производство серы превысило потребности в ней. Поэтому сере стали искать новые применения, прежде всего в таких материалоемких областях, как строительство. В результате этих поисков появились серный пенопласт — как теплоизоляционный материал, бетонные смеси, в которых серой частично или полностью заменен портландцемент, покрытия для автострад, содержащие элементную серу.
ЧЕРНАЯ СЕРА. Соединение необычного состава S4N4 получено американскими химиками в конце 70-х годов. Это вещество получалось при взаимодействии безводного аммиака с одним из хлоридов серы. Соединение — чрезвычайно нестойкое, разлагается со взрывом, и хранят его либо при очень высоком давлении, либо под слоем бензола. В этих оранжево-красных кристаллах обнаружили черные прожилки, которые, как оказалось, состоят из элементной серы. Черная сера из тетранитрида оказалась новой аллотропной модификацией давно известного простого вещества.
НЕМЕТАЛЛ — МЕТАЛЛ. В 1980 г. журнал «Письма в ЖЭТФ» опубликовал сообщение о том, что сера при высоком давлении может переходить в металлическое и даже сверхпроводящее состояние.
natural-museum.ru
